業務領域
同 心 關 愛 你 我 共 享
BUSINESS
天津美倫醫藥集團有限公司-吲達帕胺滴丸臨床研究報告
符合國家GMP標準要求的中西藥制劑生產車間、中藥提取車間、藥物研究院、天然植物化妝品生產基地、化妝品科學技術研究院等,配套設施齊全,可以充分滿足現代化、規模化、專業化、標準化生產的要求。
關鍵詞:
天津美倫醫藥集團有限公司-吲達帕胺滴丸臨床研究報告
所屬分類:
文獻資料
產品附件:

咨詢熱線:
天津美倫醫藥集團有限公司-吲達帕胺滴丸臨床研究報告
圖文詳情
美倫吲達帕胺滴丸生物利用度試驗:
依照國家藥品管理法規定,吲達帕胺滴丸屬化藥5類新藥,需進行人體生物利用度試驗并與一種符合陽性標準的對照藥進行生物等效性評價,旨在為臨床安全、有效用藥提供實驗依據。試驗工作是由上海中山醫院國家藥理臨床試驗基地,嚴格按照GCP規范進行設計并完成的。
該研究依據文獻建立了測定人全血中吲達帕胺的高效液相色譜檢測方法,這一方法在5-1000ng/ml濃度范圍內線性關系良好(r=0.9999,n=8),高、中、低三種濃度的天內、天間RSD均小于7%;提取回收率均大于80%,方法回收率在94%-103%之間。全血中吲達帕胺的最低檢測濃度為2.5ng/ml,適合于生物樣品的分析要求。
試驗藥物:
?試驗制劑:吲達帕胺滴丸(2.5mg/粒)
?參比制劑:鈉催離片(2.5mg/片)法國施維雅藥廠生產。
符合GCP臨床試驗對照藥選擇的要求,即公認、有效、已獲準上市、已獲準我國審批進口等。
受試者:
受試者按中國藥典2000年版關于藥物制劑人體生物利用度和生物等效性指導原則進行的篩選,均為男性,20名,年齡、身高、體重均符合要求,經詢問病史,血、尿常規,肝腎功能,心電圖等檢查證實的健康受試者。
給藥方案:
?將20名受試者隨機分為兩組,按表一設計采用自身對照交叉給藥方式,單劑量口服試驗制劑與參比制劑7.5mg。
表一:交叉給藥方案
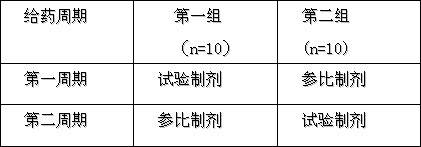
第一周期和第二周期兩次給藥間隔8天,以清除治療殘余效應。
血樣采集:
?服藥前取空白血,并分別在給藥后0.5,1,1.5,2,3、5、8、12、24、36、48、60小時共12個時間點取靜脈血做血樣分析,采用高效液相-紫外檢測方法測定全血血藥濃度。
圖3 :受試者口服試驗制劑和參比制劑血藥
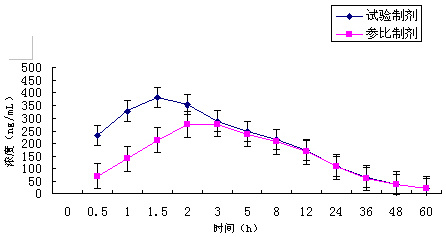
濃度平均值—時間曲線
數據處理:
?受試者口服吲噠帕胺滴丸,用梯形法計算AUC,Tmax和Cmax以實測值計算,采用統計矩方法計算其它藥動學參數,主要藥動學參數見表四。
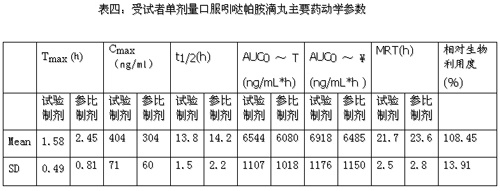
表四:受試者單劑量口服吲噠帕胺滴丸主要藥動學參數
用3p97軟件將Tmax、T1/2、Cmax、AUC0-T、AUC0-∞ 、MRT的值進行對數轉換后再進行方差分析;Cmax、AUC0-T、AUC0-∞ 的值再用雙單側t檢驗進行生物等效性的判定,計算90%的置信區間,以證明試驗制劑與參比制劑是否生物等效。
試驗結果:
根據方差分析結果表明:試驗制劑的Cmax和Tmax與參比制劑相比,均有顯著性差異,試驗制劑的Cmax和Tmax分別為404.13±70.79 ng/mL和1.58±0.49 h,參比制劑分別為304.02±59.51 ng/mL和 2.45±0.81 h。這說明試驗制劑服用后吸收快,可迅速起效。試驗制劑的MRT,T1/2與參比制劑相比無顯著性差異。
經臨床觀察口服吲達帕胺滴丸7.5mg后受試者血壓和心率比基礎值稍有降低,但未見直立性低血壓等不良反應。
根據置信區間法檢驗的結果表明:試驗制劑的AUC0-T、Cmax與參比制劑相比,均無顯著性差異。試驗制劑AUC的90%可信限落在參比制劑101.5%--111.9%的范圍內;Cmax落在125.7%--140.9%的范圍內,故試驗制劑與參比制劑生物等效(中國藥典2000版二部附錄P196)。試驗制劑平均相對生物利用度為108.45±13.91%(n=20,以AUC0-T計算)。
[不良反映]
經臨床觀察口服吲達帕胺滴丸7.5mg后受試者血壓和心率比基礎值稍有降低,但未見直立性低血壓等不良反應。
此外,研究報告附有對成品的檢驗報告,所包括性狀、鑒別、檢查有關物質、含量均勻度、溶散時限、微生物限度、含量測定等各項均符合國家標準規定。由于滴丸制劑在生產工藝,藥物穩定性、均勻性、安全性,利于吸收等方面具有一定的優勢,且有較好的性價比,為高血壓病人的治療提供了一種比較理想的新藥。
上一頁
無
下一頁
咨詢




